極性溶劑
極性溶劑是一種含有極性基團(tuán),如羥基或羰基的溶劑,其分子具有極性。這種極性是由于溶劑分子內(nèi)的正負(fù)電荷中心不重合所導(dǎo)致的。我們通常使用偶極矩或介電常數(shù)來(lái)量化分子的極性大小,介電常數(shù)較大的溶劑表明其極性較強(qiáng)。
化學(xué)共價(jià)鍵分為極性鍵與非極性鍵。非極性鍵是指共用電子對(duì)沒(méi)有偏移的鍵,例如在單質(zhì)中的O2;而極性鍵是指共用電子對(duì)發(fā)生偏移的鍵,例如在HCl中。當(dāng)電子偏移極端時(shí),一個(gè)原子似乎完全失去了電子,而另一個(gè)原子似乎獲得了電子,這就形成了離子鍵,如NaCl。
化合物的極性取決于分子中存在的官能團(tuán)和分子結(jié)構(gòu)。各種化合物的極性可以按照以下順序來(lái)增加:
—CH3,—CH2—,—CH=,—C三,—O—R,—S—R,—NO2,—N(R)2,—OCOR,—CHO,—COR,—NH2, —OH,—COOH,—SO3H
這個(gè)順序反映了不同官能團(tuán)和結(jié)構(gòu)對(duì)分子極性的貢獻(xiàn)程度。
強(qiáng)極性溶劑
甲醇〉乙醇〉異丙醇
中等極性溶劑
乙氰〉乙酸乙酯〉氯仿〉二氯甲烷〉乙醚〉甲苯
非極性溶劑
環(huán)己烷,石油醚,己烷,戊烷
單一溶劑的極性大小順序
石油醚(小) →環(huán)己烷→四氯化碳→三氯乙烯→苯→甲苯→二氯甲烷→氯仿→乙醚→乙酸乙酯→乙酸甲酯→丙酮→正丙醇→甲醇→吡啶→乙酸(大)
混合溶劑的極性順序
苯∶ 氯仿(1+1)→ 環(huán)己烷∶乙酸乙酯(8+2 )→氯仿∶丙酮(95+5 )→苯∶丙酮(9+1 )→苯∶乙酸乙酯( 8+2)→氯仿∶乙醚( 9+1)→苯∶甲醇( 95+5) →苯∶乙醚( 6+4)→環(huán)己烷∶乙酸乙酯( 1+1 )→氯仿∶乙醚( 8+2)→氯仿∶甲醇( 99+1)→苯∶甲醇( 9+1)→氯仿∶丙酮( 85+15 )→苯∶乙醚( 4+6)→苯∶乙酸乙酯( 1+1)→氯仿∶甲醇( 95+5 )→氯仿∶丙酮( 7+3)→苯∶乙酸乙酯( 3+7)→苯∶乙醚( 1+9)→乙醚∶甲醇( 99+1 )→乙酸乙酯∶甲醇( 99+1 )→苯∶丙酮( 1+1 )→氯仿∶甲醇( 9+1)
說(shuō)明一下: 苯∶甲醇( 95+5 )的意思是95 體積的苯混合5 體積的甲醇配成混合溶劑
常用混合溶劑
乙酸乙酯/ 己烷:常用濃度0~30%。但有時(shí)較難在旋轉(zhuǎn)蒸發(fā)儀上完全除去溶劑。
乙醚/ 戊烷體系:濃度為0~40%的比較常用。在旋轉(zhuǎn)蒸發(fā)器上非常容易除去。
乙醇/ 己烷或戊烷:對(duì)強(qiáng)極性化合物5~30%比較合適。
二氯甲烷/ 己烷或戊烷:5~30%,當(dāng)其他混合溶劑失敗時(shí)可以考慮使用。
官能團(tuán)極性大小比較
烷烴( —CH3,—CH2—)<烯烴( —CH=CH —)<醚類(lèi)( —O—CH3,—O—CH2—)<硝基化合物(—NO2) <二甲胺( CH3—N—CH3)<脂類(lèi)( —COOR )<酮類(lèi)( —CO—)<醛類(lèi)(—CHO)<硫醇(—SH)<胺類(lèi)(—NH2)<酰胺(—NHCO—CH3)<醇類(lèi)(—OH)<酚類(lèi)(< Ar—OH)<羧酸類(lèi)( —COOH )。
常用流動(dòng)相極性
石油醚<汽油<庚烷< 己烷<二硫化碳<二甲苯<甲苯<氯丙烷<苯<溴乙烷<溴化苯<二氯乙烷(DCM) <三氯甲烷<異丙醚<硝基甲烷<乙酸丁酯<乙醚< 乙酸乙酯<正戊烷<正丁醇<苯酚<甲乙醇<叔丁醇<四氫呋喃<二氧六環(huán)<丙酮< 乙醇<乙腈<甲醇<氮氮二甲基甲酰胺(DMF) <水。
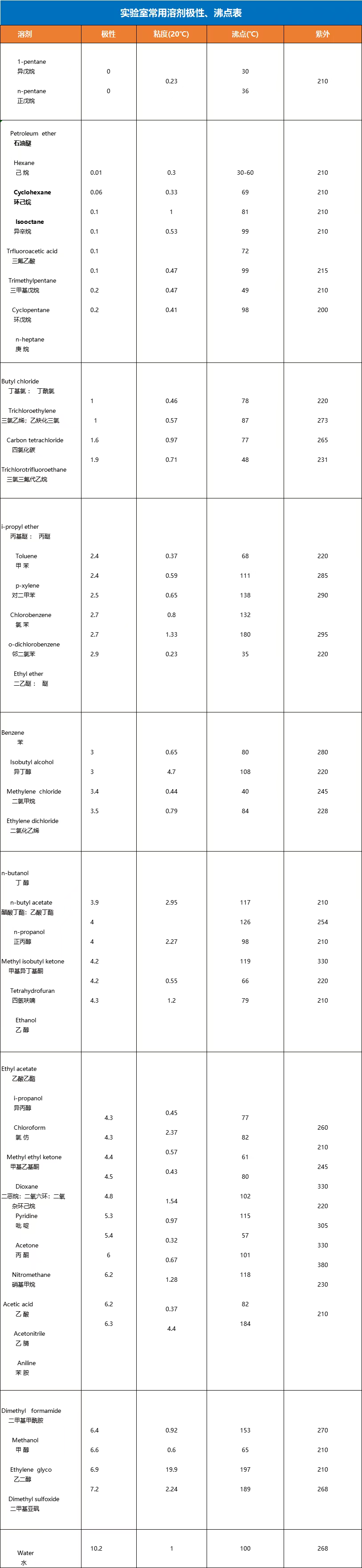
表示有機(jī)溶劑的極性,關(guān)系到其物理化學(xué)性質(zhì)、如介電常數(shù)、偶極矩或折射率。這種表示方法把所有的溶劑看作是連續(xù)作用的介質(zhì),而不是看作由各個(gè)分子組成的非連續(xù)統(tǒng)一體,并且未考慮到溶劑和溶質(zhì)之間的特殊的相互作用。
【免責(zé)聲明】發(fā)布內(nèi)容來(lái)源于互聯(lián)網(wǎng)、業(yè)內(nèi)人士投稿以及微信公眾號(hào)等公開(kāi)資源,我們對(duì)文中觀(guān)點(diǎn)持中立態(tài)度,文中觀(guān)點(diǎn)不代表本平臺(tái)的立場(chǎng)。所有文章僅供讀者參考和交流使用。轉(zhuǎn)載的文章版權(quán)歸原作者所有,如有侵權(quán)行為,請(qǐng)及時(shí)與我們聯(lián)系以便刪除。

 艾米
艾米




